* ملحوظة: المقال من كتاب (العلم وأصل الإنسان)، لتفاصيل أكثر يرجى مراجعة الكتاب.
قدم فرانسيس كولينز -رائد أنصار التطور الإلهي- حجتين جينيتين لكي يدلل على وجود سلف مشترك بين الإنسان والقردة العليا وهما: الدنا الخردة Junk DNA والاندماج الصبغي Chromosomal Fusion. فأما الأولى -وهي الدنا الخردة-؛ فقد سقطت لأن الدنا غير المشفر Non-Coding DNA له وظائف خلوية مهمة، ولذلك فهو ليس (خردة). وأما الحجة الثانية وهي (الاندماج الصبغي)؛ فقد هوت هي الأخرى، لأن أقصى ما تشير إليه هو أن الجنس البشري قد شهد وجود حدث الاندماج الصبغي، ولا تشير إلى كون نسب الإنسان يرجع إلى سلف مشترك مع القردة.
في كتابه الأكثر مبيعًا (لغة الإله The Language of God) الصادر عام 2006، يدَّعي عالم الوراثة فرانسيس كولينز أن الدنا البشري: "يقدم دعمًا قويًّا لنظرية داروين للتطور، وهي الانحدار من سلف مشترك نتيجة الانتقاء الطبيعي الذي يعمل على التنوعات العشوائية(1)، وبشكل أكثر تحديدا؛ فإن الدنا البشري يثبت أن الإنسان والقردة العليا يتشاركان في سلف مشترك".
كان كولينز -الذي يرأس مشروع الجينوم البشري- في السابق معروفًا بانتمائه للطائفة المسيحية الإنجيلية، وأنه يتقبل كلا من نظرية التطور الدارويني والأبحاث المختصة بالخلايا الجذعية الجنينية(2)، وفي عام 2008م حصل كولينز على 2 مليون دولار كمنحة من مؤسسة جون تيمبلتون ساعدته في إقامة مؤسسة بيو لوجوس BioLogos التي تهدف لإقناع الزعماء المسيحيين والعوام بنظرية التطور(3)، وتنحى كولينز عن تلك المؤسسة بعدما عيّنه باراك أوباما -رئيس الولايات المتحدة الأمريكية- مديرًا للمعاهد القومية للصحة (NIH)، لكن دفاعه المتشدد عن السلف المشترك بين الإنسان والقردة العليا مازال ذا تأثير واسع في المجتمع المؤمن، حيث قدم كولينز حجتين رئيسيتين تستند كل منهما على الدنا ليدلل بهما على ادعائه أن الإنسان يشترك مع القردة العليا بسلف مشترك وكذلك مع الحيوانات الأخرى.
الحجة الأولى هي أن الإنسان يشترك مع الثدييات الأخرى في الدنا غير المشفر الذي يفترض أنه ليست له أي وظيفة -خردة-، وهذا يعني وفقا لكولينز: "استنتاج أن السلف المشترك بين الإنسان والفئران أمر لا مفر منه تقريبا".(4)
الحجة الثانية هي أن الصبغي البشري رقم (2) قد نتج عن اندماج صبغيين يشبهان نظيرهما لدى القردة، ويرى كولينز ذلك دليلا يصعب فهمه دون افتراض وجود سلف مشترك بين الإنسان والقردة.(5)
هذه هي أكثر حجج التطوريين شيوعا لإثبات وجود السلف المشترك بين الإنسان والقردة ولكن -كما سنرى لاحقا في هذا الفصل- فقد استند كولينز بصورة كبيرة على علوم قد عفا عليها الزمن، وعلى افتراضات مشكوك في صحتها، وبصورة أكثر تحديدا:
- كشفت العديد من الدراسات النقاب عن أدلة كثيرة على وجود وظائف للحمض النووي غير المشفر والذي تبين أنه ليس مجرد خردة جينية بأي حال.
- من الممكن أن يشير الاندماج الصبغي في البشر إلى أن الجنس البشري قد شهد حدث الاندماج هذا، ولكنه لا يخبرنا أيَّ شيء عن نسب الإنسان والسلف المشترك مع القردة، وعلاوة على ذلك فإن هذا الدليل الجيني -الاندماج الصبغي في البشر- ليس بتلك القوة التي يصوره بها كولينز والآخرون.
وباختصار؛ فإن الدليل الذي يستند على الدنا لا يثبت استنتاج كولينز عن تطور البشر.
الدنا غير المشفر ليس خردة بعد الآن!
يُحسب لكولينز أنه تجنب تلك الحجة الاعتيادية البسيطة التي تقول بأن التشابه الجيني الوظيفي بين نوعين يقتضى اشتراكهما بسلف واحد، معترفًا بأن التشابه الجيني الوظيفي بمفرده لا يبرهن بطبيعة الحال على وجود هذا السلف المشترك؛ وذلك لأن المصمم قادر على استخدام نفس قواعد التصميم الناجحة مرارًا وتكرارا،(6) وبدلًا من ذلك قدم كولينز حجة مختلفة، حيث أنه استشهد بوجود نوع من الدنا يسمى العناصر المكررة القديمة (ancient repetitive elements أو AREs) بزعم أنها بلا وظيفة (خردة)(7)، وذلك -في نظره- يدل على صحة التطور الدارويني والسلف المشترك بين الإنسان والقردة العليا.
العناصر المكررة القديمة (AREs) شائعة الوجود في جينوم الثدييات وهي موجودة عندنا نحن البشر وكذلك عند القردة العليا والفئران، وهي موجودة في نفس الموقع الجينومي لدى كل هذه الكائنات. يؤكد كولينز أن تلك العناصر المكررة القديمة AREs هي بمثابة "حطام جيني مهمل بلا قيمة، وهي تمثل تحديًا ساحقًا لهؤلاء الذين يحملون فكرة أن كل أنواع الكائنات الحية قد وجدت بطريق الخلق الخاص المستقل". ومن وجهة نظر كولينز فإن استنتاج وجود سلف مشترك للبشر والفئران لا مفرَّ منه عمليا إلا بافتراض أن الإله قد وضع تلك العناصر المكررة القديمة AREs عديمة الفائدة في تلك المواقع الدقيقة من الدنا إرباكًا وتضليلًا لنا!(8) ومن الأصوات العالية أيضا ككولينز في هذا الصدد، الملحد الدارويني (ريتشارد دوكينز) الذي كتب أيضا: "ربما يجب على الذين يؤمنون بالخلق أن يقضوا أوقاتا جادة متأملين هذا السؤال: لماذا يكلف الخالق نفسه العناء في وضع جينوم به تكرارات متتالية من الخردة؟".(9)
الجدير بالذكر أن كلًا من كولينز ودوكينز قد قدم حجة لاهوتية مبنية على أساس أن الله لا يفعل ذلك بتلك الطريقة، بدلا من تقديم ادعاء علمي، وأنا سأترك اختبار مدى صحة ومتانة نظرتهم اللاهوتية لغيري، لكن نظرتهم العلمية قد تبدلت بالأدلة.
وباطلاع خاطف على المنشورات العلمية نجد عكس ما يدعيه كل من دوكينز وكولينز، وأن الدنا المكرر -كغيره من أنواع الدنا غير المشفر- ليس مجرد خردة جينية بلا فائدة، حيث أدرك العلماء الذين يمتلكون عقولا متفتحة ذلك قبل أن يكتب كولينز كتابه بفترة طويلة؛ ففي عام 2002م قام عالم الأحياء ريتشارد شتينبرغ بدراسة إحصائية للمنشورات العلمية المختصة بهذا المجال ووجد أدلة مستفيضة لوجود وظائف لتلك العناصر المكررة القديمة (AREs)، وكتب في سجلات أكاديمية نيويورك للعلوم أنه وجد أن وظائف العناصر المكررة القديمة (AREs) تشمل الآتي:
تكرارات التوابع Satellite repeats تشكل البنى الهيكلية العليا للنواة.
تكرارات التوابع تشكل الجسيم المركزي centromeres.
تكرارات التوابع وغيرها من العناصر المكررة REs تشارك في عملية تكثف الكروماتين.
التكرارات الانتهائية Telomeres والعناصر النووية الطويلة المتخللة LINE.
العناصر النووية الكروماتينية الفاصلة للعناصر الانتهائية Subtelomeric nuclear positioning /chromatin boundary elements.
العناصر النووية الكروماتينية الفاصلة اللاانتهائية المتخللة Non-TE interspersed chromatin boundary elements.
العناصر النووية القصيرة المتخللة (SINEs) تعمل كمراكز نووية لإتمام عملية المثيلة.
العناصر النووية القصيرة المتخللة (SINEs) تعمل كعناصر كروماتينية فاصلة.
العناصر النووية القصيرة المتخللة (SINEs) المشاركة في عملية التكاثر الخلوي.
العناصر النووية القصيرة المتخللة (SINEs) المشاركة في الاستجابة للشدة الخلوية.
العناصر النووية القصيرة المتخللة (SINEs) المشاركة في الترجمة -ربما يكون لها علاقة بالاستجابة للشدة الخلوية-.
العناصر النووية القصيرة المتخللة (SINEs) المشاركة في ربط بروتين الكوهيزين cohesion بالصبغيات.
العناصر النووية الطويلة المتخللة (LINEs) المشاركة في عملية إصلاح الدنا.(10)
استنتج شتينبرغ أن: "تلك الروايات التي قد تم سردها عن وجود الدنا الخردة مرتبطة بالأيقونات الأخرى للنظرية التطورية الداروينية الجديدة، وبالرغم من تباينها عن العلم التجريبي إلا أن البعض مستمر في نشرها".(11)
استمرت أبحاث جينية أخرى في هذا الصدد لتكشف النقاب عن وظائف الأنواع المختلفة لتكرارات الدنا التي تشمل: العناصر النووية القصيرة المتخللة SINEsـ(12)، والعناصر النووية الطويلة المتخللة LINEsـ(13) وكذلك عناصر Aluـ(14) حتى أن هناك ورقة اقترحت دور تسلسلات Alu المتكررة في إنماء الوظائف العليا للدماغ البشري.(15)
كما تم اكتشاف وظائف أخرى متعددة لأنواع مختلفة من الدنا غير المشفر، وتشمل:
إصلاح الدنا.(16)
المساعدة في عملية نسخ الدنا.(17)
تنظيم عملية نسخ الدنا.(18)
المساعدة في عملية طي الصبغيات ودعمها.(19)
التحكم في عمليات تحرير الرنا RNA وتضفيره.(20)
المساعدة في مكافحة الأمراض.(21)
تنظيم عمليات النمو الجنيني.(22)
توقع شتينبرج مع جيمس شابيرو -عالم الوراثة من جامعة شيكاغو- في عام 2005م أنه: "سيأتي ذلك اليوم الذي ستسقط فيه فكرتنا عما اعتدنا على تسميته بالدنا (الخردة)، وسنجد أنه مكوِّن أساسي لأنظمة التحكم الخلوي والتي هي في الحقيقة (متخصصة)".(23)
لقد جاء اليوم الذي توقعه شتينبرج وشابيرو أسرع مما كانا يتوقعان، ففي عام 2007م نشرت صحيفة (الواشنطن بوست) تقريرًا يفيد بأن المشروع العلمي الضخم المعروف بمشروع إنكود (ENCODE) قد توصل إلى أن: "الغالبية الساحقة من الشفرة الجينية المكتوبة عند البشر -والتي تقدر بثلاثة مليارات أساس- تقوم بمجموعة من الوظائف التي لم تكن معروفة من قبل".(24)
وحسبما أفادت مقالة في مجلة Nature حول هذا المشروع فإن: "النظرة الحيوية الجديدة لعالم الدنا غير المشفر -الذي اعتدنا على تسميته بالدنا الخردة- جذابة ومربكة، وقد أظهرت نتائج الباحثين في المشروع التعاوني العالمي المعروف بموسوعة عناصر تكويد الدنا DNA (ENCODE) أن ما بين (74%- 93%) من الدنا الموجود في جزء محدد من الجينوم -والذي يحتوي نسبة ضئيلة من التسلسلات البروتينية المشفرة- قد تم نسخه إلى الرنا".
لمعظم الدنا غير المشفر دور تنظيمي، إذ يبدو أن للأحماض النووية الريبوزية الصغيرة (small RNAs) على اختلاف أنواعها أهمية في التحكم بعملية التعبير الجيني على مستوى الدنا ونسخ الرنا بطرق بدأت في التكشف حديثا. (25)
وفى عام 2007م ظهرت ورقة علمية في مجلة Nature Reviews Genetics بعنوان (عمليات النسخ الواسع واشتراكها في عمليات التنظيم الجيني) تناقش مدى اتساع وتعقيد وحيوية تلك الوظائف الغامضة للحمض النووي غير المشفر، وتنص على ما يلي: "يشير الدليل إلى حدوث انتساخ لمعظم طاقي الجينوم البشري، مما يعنى أن هناك تداخلًا واسعًا بين الوحدات المنتسخة والعناصر التنظيمية، وتقترح تلك المشاهدات أن بنية الجينوم ليست خطية تشاركية، وإنما بنية متداخلة ومركبة من وحدات، وأن نفس التسلسلات الجينية لها وظائف متعددة؛ أي أنها تُستخدم في كثير من عمليات النسخ المنظمة والمستقلة، وتعمل أيضا كمناطق تنظيمية".(26)
وكذلك ظهرت ورقة علمية في مجلة Science عام 2008م تكشف أن كل أجزاء جينوم الكائنات حقيقية النواة تقريبا (والتي تمت دراستها بشكل جيد) يتم نسخها، وهذا يؤدي لكميات هائلة من جزيئات الرنا غير المشفرة للبروتينات ولها وظائف مؤكدة: "كشفت السنوات القليلة الماضية أن الجينوم الخاص بحقيقيات النوى المدروسة يتم نسخه بشكل كامل تقريبا منتجًا بذلك عددًا هائلًا من جزيئات الرنا غير المشفرة لبروتينات وتسمى (ncRNAs). وبالتوازي مع ذلك تتزايد الأدلة بأن للعديد من تلك الجزيئات وظائف تنظيمية، سنسلط الضوء هنا على تلك الخطوات الحديثة التي وضحت أن جزيئات ncRNAs باختلاف أنواعها تتحكم في ديناميكية الجينوم وحيوية الخلية، وكذلك في البرمجة النمائية الجنينية".(27)
وتتابع تلك الورقة العلمية تفصيل الأدوار الهامة لتلك العناصر المكررة في التحكم بالخلية قائلة: "قد تمثل وفرة التسلسلات المكررة المنسوخة استراتيجية شاملة في الجينوم للتحكم بمناطق الكروماتين، وقد تكون محفوظة conserved عبر الكائنات حقيقيات النوى".(28)
وفي عام 2003م صرحت مقالة في مجلة Science بأن مسميات (الدنا الخردة) كالتي استخدمها كولينز قد ثبطت همم العلماء عن العمل لاكتشاف وظائف العناصر المكررة غير المشفرة: "على الرغم من جاذبية مصطلح (الدنا الخردة) إلا أن ذلك المصطلح قد صد أغلب الباحثين عن دراسة الدنا غير المشفر لسنوات عديدة، ومن ذا الذي سيقحم نفسه في دراسة مخلفات الجينوم، باستثناء ذلك العدد القليل من الشاردين في طريق بحثهم له؟ وبالرغم من ذلك فإنه يوجد في العلم -كما في الحياة العادية- بعض الشاردين المتحملين لسخرية غيرهم أثناء اكتشافهم للمناطق غير المأهولة أو غير المعروفة من قبل، وبسبب هؤلاء بدأت تتغير نظرة الباحثين للحمض النووي الخردة -وخاصة العناصر المتكررة- في أوائل التسعينيات من القرن الماضي، والآن يوجد العديد والعديد من علماء الأحياء الذين يعتبرون أن العناصر المكررة كنز موجود في الجينوم".(29)
وبالرغم من كون الافتراضات الداروينية المعارضة واسعة الانتشار إلا أن تلك الورقة قد استنتجت أن: "العناصر المكررة ليست بلا فائدة، بل إنها -بالأحرى- مكونات تكاملية مهمة في جينوم حقيقيات النوى".(30)
بالإضافة إلى العناصر المكررة يوجد نوع آخر من الدنا الخردة الذي كان كولينز معجبا به ليدعم وجود السلف المشترك بين الإنسان والقردة؛ هذا النوع هو الجين الكاذب pseudogene، وكتب كولينز في كتابه (لغة الإله) أن الجين الكاذب caspase-12 بلا وظيفة عند الإنسان، ثم تساءل: "لماذا خلق الإله تلك المشكلة بوضع جين بلا وظيفة في ذلك الموقع الدقيق؟".(31) وقد وضع نفس الحجة في كتابه التالي الصادر عام 2011م (لغة العلم والإيمان) مستشهدا بجين يصنع الفيتامين C في البشر، والذي من المفترض أنه جين كاذب بلا وظيفة قائلا: "إن الادعاء بأن الجينوم البشري قد خلقه الإله خلقًا مستقلًّا بدلًا من انحداره من سلف مشترك يعني أن الإله قد وضع قطعة معطلة من الدنا في الجينوم الخاص بنا، وذلك غير معقول نهائيا".(32)
وبالمثل استشهد كينيث ميلر -عالم الأحياء بجامعة براون- بذلك الجين الكاذب على أنه دليل حاسم في قضية السلف المشترك، وذلك لأن؛ "السلف المشترك هو التفسير الوحيد الممكن لوجود العديد من الأخطاء المتماثلة في نفس الجين".(33)
لكن، هل الجينات الكاذبة بلا وظائف؟ وهل هي دنا معطل؟ كما هو الحال في العناصر المكررة القديمة (AREs) فقد تم اكتشاف العديد من الوظائف لهذه الجينات(34)، وأعلن عالما أحياء مهمان -وهما محرران في Annual Review of Genetics- أن: "الجينات الكاذبة التي تم فحصها لها أدوار وظيفية غالبا".(35) وكذلك صدرت ورقة علمية عام 2011م في مجلة رنا RNA بعنوان (الجينات الكاذبة: هل هي بلا وظائف أم أنها مفاتيح تنظيمية مهمة في الصحة والمرض؟)، وتعلن هذه الورقة عدم صلاحية إطلاق مصطلح الدنا الخردة على هذه الجينات، وأنها ليست نسخًا من بقايا الجينات التي حملناها أثناء عملية التطور، وقد ظهرت نتائج حديثة تحدَّت مصطلح (الخردة)؛ إذ وجد لبعض الجينات الكاذبة أهمية في تنظيم الجينات المشفرة للبروتينات المشابهة".(36)
اقترحت دراسة أن الجين الكاذب (caspase-12) الذي استشهد به كولينز(37) قادرٌ على إنتاج بروتين يسمى (CARD-only protein)(38)؛ وهو نوع من البروتينات التي لها دور وظيفي لدى البشر(39)، وقد أشارت تلك الدراسة إلى أن الجين الكاذب المسمى بـ(caspase-12) متورط ببعض مسارات العمليات الحيوية، مما حفَّز العلماء على دراسة ذلك الجين الكاذب كي يفهموا وظيفته: "من المشوق دراسة مشاركة الجين الكاذب (caspase-12) في مسارات حيوية مشابهة لتلك التي تقوم بها الجينات المشابهة له بنيويا، كالجين المسمى بـ(ICEBERG)، وكذلك الجين المسمى بـ(COP/Pseudo-ICE) وهي من CARD-only proteins"ـ(40)
لقد أخطأ كولينز عندما ادعى ببساطة -رغم جهلنا الشديد بالدنا غير المشفر- أن الأغلبية العظمى من الدنا المكرر بلا وظائف، وأنه "حطام جيني بلا قيمة"، وأن الجينات الكاذبة هي عبارة عن حمض نووي معطل، لقد كشفت الثورة التي حدثت في آخر 5-10 سنوات في مجال الجينوم النقاب عن عدد كبير من الوظائف التي تقوم بها عناصر الدنا غير المشفر. ومن المفارقات أن كولينز نفسه قد شارك في بعض تلك الأبحاث كرئيس لمشروع الجينوم البشري (Human Genome Project)، وهذا يفسر تراجع كولينز عن فكرة الدنا (الخردة) في السنة التالية لإصدار كتابه (لغة الإله)؛ حيث ادعى أحد الصحفيين أن: "كولينز قد توقف عن إطلاق ذلك المصطلح".(41)
رغم التراجع الواضح لكولينز، إلا أن مؤسسة (BioLogos) التي شارك كولينز في تأسيسها لا تزال مستمرة في نشر صورة الدنا الخردة بين أعضاء المجتمع المؤمن للتدليل على وجوب اعتناقهم لفكرة التطور الحيوي،(42) إن الدنا الخردة قد أصبح مصطلحا من الماضي في النظرة للحمض النووي غير المشفر، والاستدلال به على وجود سلف مشترك بين الإنسان والقردة العليا محل شك كبير.
الاندماج الصبغي دون سلف مشترك
الحجة الرئيسية الثانية التي احتاجها فرانسيز كولينز ليدلل على وجود السلف المشترك بين الإنسان والقردة هي ادعاؤه بأن بنية الصبغي البشري رقم (2) تشبه بنية الصبغي الذي نتوقع تكوّنه باندماج نهايات اثنين من صبغيات الشمبانزي مع بعضهما؛ فلدى البشر 23 زوجا من الصبغيات في حين يملك الشمبانزي والقردة العليا 24 صبغيّا، ويحتج كولينز في كتابه (لغة الإله) بأن الاندماج الصبغي يفسر امتلاك البشر لعدد من الصبغيات أقل بزوج واحد من القردة، وقال: "إنه لمن الصعب جدًا أن نفهم ذلك دون التسليم بوجود سلف مشترك".(43)
بالعكس تماما؛ فمن السهل جدا فهم هذا الدليل دون التسليم بوجود سلف مشترك، وعلى افتراض أن الصبغي البشري رقم (2) هو ناتج اندماج كما يدعي كولينز فإن الاندماج الصبغي يشير إلى أن الاندماج بين صبغيين قد حدث يومًا ما عند أجدادنا، وعند الحديث بمنطقية؛ فإن هذا لا يعني أننا ننحدر من سلف مشترك مع القردة أو أن البشر الأوائل كانوا يشبهون القردة بشكل ما.
حتى لو امتلك أسلافنا 24 زوجا من الصبغيات يوما ما فهذا لا يعني اختلافهم نهائيًّا عن البشر المعاصرين، يلاحظ عالم الأنثروبولوجيا جوناثان ماركس من جامعة كارولينا الشمالية التالي بقوله: "ليس الاندماج الصبغي هو الذي منحنا اللغة أو جعلنا نمشي على رجلين بدلا من أربع، ولا هو الذي منحنا الدماغ الكبير أو صناعة الفن أو القدرة على مضغ العلكة، إنه مجرد تغير من التغيرات المحايدة فاقدة المعنى، ولا يمكن القول بأنها جيدة أو سيئة في حد ذاتها".(44)
بأحسن الأحوال، يشير دليل الاندماج الصبغي في البشر ضمنا إلى أن واحدًا من أجدادنا قد شهد حدث الاندماج الصبغي، وأصبح الاندماج ثابتًا في الجماعة البشرية فيما بعد، لكن هذا الدليل لا يخبرنا أي شيء عن اشتراكنا مع القردة بسلف مشترك.
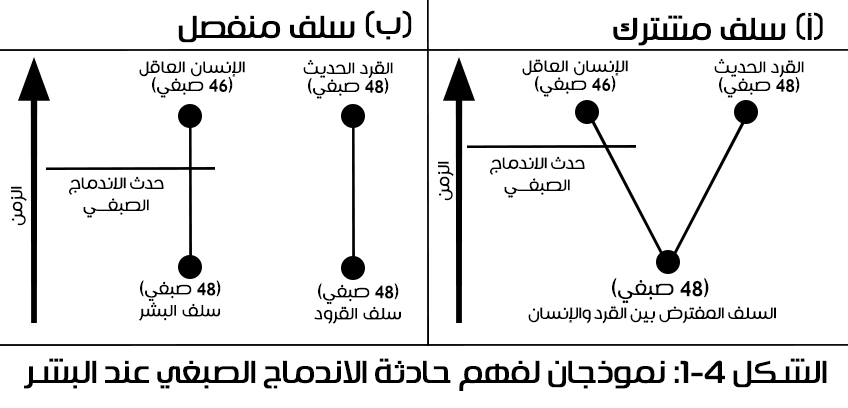
لا يقدم الاندماج الصبغي في البشر برهانا يثبت اشتراك الإنسان والشمبانزي بسلف واحد، يمكن تفسير هذا الاندماج بوجود السلف المشترك (A) أو بالتصميم المشترك (B) الذي لا يفترض وجود سلف مشترك بين الأنواع، وإذا نظرنا من خارج الصندوق الدارويني فسيغدو السيناريو التالي متساويًا في الاحتمالية مع السلف المشترك:
تم تصميم سلالة الإنسان بشكل منفصل عن سلالة القردة.
شهدت سلالتنا حدث الاندماج الصبغي.
انتشرت هذه السمة في الجماعة البشرية أثناء عبورها "عنقَ الزجاجة" الجينية (وهي المرحلة التي أصبح فيها عدد أفراد الجنس البشري ضئيلا).
في هذا السيناريو يظهر حدث الاندماج دون الحاجة للسلف المشترك مع القردة، كما هو مبين في الشكل 1-4، ويلائم النموذج (B) الواقع تماما كالنموذج (A)، ففي النموذج (B) لا يشترك الإنسان مع القردة بسلف واحد؛ فإن كان الجنس البشري قد شهد حدث الاندماج الصبغي، فإنّ هذا النموذج يظهر سهولة تفسير حدث الاندماج الصبغي دون افتراض وجود سلف مشترك مع القردة.
ولمزيد من توضيح فكرة عدم دلالة الاندماج الصبغي على السلف المشترك بين الإنسان والقردة لنتخيل الموقف الافتراضي الآتي: في عام 2050م شهد أفراد قبيلة بشرية صغيرة ومعزولة حدث اندماج صبغي ثان -مع بقائهم طبيعيين قادرين على الإنجاب-، وسنطلق على هذه القبيلة لقب (البشر ذوي الاندماج الصبغي المضاعف)، وفي عام 2100م شهد العالم حروبا وأمراضا ومجاعاتٍ دمرت الباقي من البشرية؛ ونجا أفراد هذه القبيلة، وعمّروا الأرض ثانية، وأعادوا اكتشاف علم الوراثة والتطور، أخيرا؛ قام هؤلاء البشر بإنتاج التكنولوجيا اللازمة لفحص الصبغيات الخاصة بهم، وعندها صرح علماؤهم قائلين: "نحن البشر ذووا الاندماج الصبغي الثاني نملك 22 زوجا من الصبغيات تشمل زوجين اثنين من الصبغيات المندمجة، في حين أن القردة العليا تمتلك 24 زوجا من الصبغيات؛ ولذلك فلا بد أننا قد انحدرنا من مخلوق شبيه بالقردة ولديه 48 صبغي!".
نرى من ناحيتنا أن هؤلاء البشر ذوي الاندماج الصبغي الثاني مؤخرًا بعيدون عن الاستدلال على وجود سلف مشترك بين الإنسان والشمبانزي، وقد قدموا أسبابًا منطقية واهية لإثبات هذا السلف، لمَ علينا الاقتناع بأن هذه القصة تختلف عن حالتنا الحقيقية بوجود اندماج صبغي واحد بدلا من اثنين؟ لا يزال الكثير من علماء التطور يخطئون في نظرتهم إلى الاندماج الصبغي في زوج واحد -تماما كما أخطأ هؤلاء البشر ذووا الالتصاق الصبغي الثاني.
قد يرد الدارويني قائلا: "إن دليل الاندماج الصبغي يشير لامتلاك أسلافنا 48 صبغيًّا كما هو الحال اليوم مع الشمبانزي والقردة العليا، وعلاوة على ذلك فإن الصبغي البشري رقم (2) الناتج عن عملية الاندماج الصبغي يتكون من قطع تشبه تلك الموجودة في الصبغيين (2a) و (2b) في القردة، تتنبأ نظرية السلف المشترك بكل تلك النتائج". يستخدم هذا الرد الدارويني حقيقة امتلاك الإنسان والقردة لنفس البنى الجينية تقريبا، لكن الدرجة العالية من التشابه الجيني الوظيفي بين الإنسان والشمبانزي لا تثبت بالضرورة وجود السلف المشترك؛ ففي الفصل الأول قامت (آن جوجر) بتبيان لماذا لا يثبت التشابه الجيني الوظيفي بين البشر والشمبانزي وجود السلف المشترك: فقد تَنتج التشابهات الجينية الوظيفية نظرا للمتطلبات الوظيفية والتصميم المشترك، وليس لكونها موروثة من سلف مشترك، في الواقع -وكما رأينا مما سبق- حتى فرانسيز كولينز قد اعترف بأن: "التشابه الجيني الوظيفي بمفرده لا يبرهن بطبيعة الحال على وجود السلف المشترك؛ لأن المصمم قد يستخدم قواعد التصميم الناجحة مرارًا وتكرارا".
إن دليل الاندماج الصبغي في أحسن أحواله يعزز الشيء الذي نعلمه جميعا؛ وهو وجود التشابه الجيني الكبير بين الشمبانزي والإنسان، قد تكون تلك التشابهات الوظيفية ناتجة عن المتطلبات الوظيفية التي وضعها المصمم الواحد.
كل ما ذكرناه سابقًا صحيح في حال افترضنا صحة وقوع حدث الاندماج الصبغي في التاريخ البشري، لكن ما هو مدى متانة الدليل الحقيقي لذلك الادعاء المثير للجدل؟
يدعي عالم الأحياء كينيث ميلر في معرض استخدامه للاندماج الصبغي كدليل على وجود السلف المشترك بين الإنسان والشمبانزي أن: "دليل وجود النسب استنباطا من قضية الصبغي المفقود لا يتطرق إليه الشك"،(45) ولكن الحقيقة أن الدليل على حدوث الاندماج الصبغي ليس واضحًا بهذا الشكل القاطع الذي يدعيه التطوريون أمثال كينيث ميلر.
يحتوي الدنا الانتهائي (Telomeric DNA) الموجود في نهاية الصبغيات في الحالة الطبيعية على آلاف التكرارات من سلسلة مكونة من ستة أسس (TTAGGG)، ولكن نقطة الالتصاق المزعومة في الكروموسوم البشري رقم (2) تحتوي على حمض نووي انتهائي أقل بكثير مما يفترض وجوده في حال حدوث الاندماج بين صبغيين من أطرافهما، يعترف عالم الأحياء التطورية دانيل فيربانكس بأن الموقع يحتوي 158 تكرارًا فقط منها 44 نسخة كاملة فقط. (46)
بالإضافة إلى ذلك، وجدت ورقة علمية منشورة في مجلة Genome Research أن تلك التسلسلات التيلوميرية المزعومة لدينا "متدرّكة بشكل ملحوظ ومختلفة بدرجة كبيرة عن التكرارات التيلوميرية النموذجية". أظهرت الورقة تفاجؤها من هذا الاكتشاف لأن حدث الاندماج المفترض قد وقع منذ زمن قريب، وهذا الزمن أقصر مما ينبغي لتظهر تلك الاختلافات الكبيرة في التسلسل، لذلك تطرح الورقة هذا التساؤل: "لو حدث الاندماج الصبغي منذ أقل من ستة ملايين عام فلماذا تدركت التسلسلات في موضع الالتصاق لهذا الحد؟".(47) نستنتج من هذا أن الإقرار بحدث اندماج صبغي بين نهايتي الصبغيين يستدعي الإقرار بفقدان -أو تخرب- كمية كبيرة من الدنا التيلوميري المزعوم.
وأخيرًا؛ فإن وجود الدنا التيلوميري في صبغيات الثدييات ليس نادرًا، كما أنه لا يشير بالضرورة إلى وجود نقطة اندماج قديمة بين زوج من الصبغيات. يشير عالم الأحياء التطورية ريتشارد شتينبرج إلى أن التسلسلات التيلوميرية البينية interstitial telomeric sequence (ITSs) شائعة الوجود في جينوم الثدييات، لكن علماء التطور ينتقون بقايا التسلسلات التيلوميرية الموجودة في (الصبغي البشري 2) ليستشهدوا بها على حدوث الاندماج الصبغي: "من بين جميع التسلسلات التيلوميرية الخلالية ITSs المعروفة -يوجد منها الكثير في جينوم الشمبانزي والإنسان كما هو الحال في جينوم الفئران والجرذان والبقر- فإن التسلسلات التيلوميرية الخلالية الوحيدة التي يمكن أن تكون مرتبطة بموضع تطور أو حدث اندماج صبغي هي تسلسلات ITSفي الموضع 2q13، لا تشير ITSs الأخرى إلى نهايات صبغيات مندمجة لدى الرئيسيات، وبالمختصر إن تسليط الضوء على تكرارات ITS في الموضع 2q13 هو انتقاء محض للبيانات".(48) إذ ليس معظمها ندوبا في شريط الدنا كما يحلو للبعض تصويرها.
هناك ثلاثة أسباب على الأقل توضح اختلاف الدليل عما تتنبأ به قصة الاندماج الصبغي:
تحتوي نقطة الاندماج المزعوم في (الصبغي البشري 2) عددًا أقل بكثير من ITS المفترض وجودها.
التسلسلات التيلوميرية المفترضة متدرّكة بشدة وبعيدة جدًا عما نتوقعه فيما لو كان الاندماج الصبغي قد حدث منذ زمن قريب.
اكتشاف وجود ITS في صبغيات الثدييات ليس نادرًا ولا يشير بالضرورة إلى حدث اندماج صبغي.
لكن -وهنا مربط الفرس- حتى لو كان (الصبغي البشري 2) ناتجا عن اندماج زوج من الصبغيات؛ فإن ذلك ليس دليلا على وجود السلف المشترك، يشهد ذلك في أحسن الأحوال على أن أجداد البشر اليوم قد شهدوا حادثة الاندماج الصبغي، ولكنه لا يخبرنا أي شيء عما إذا كان نسبنا يرجع إلى سلف مشترك مع القردة.
الخلاصة
طرحت في السنوات القليلة الفائتة عدة حجج جينية أمام العامة على أنها براهين جديدة حاسمة على أن الإنسان يشترك في سلف واحد مع القردة والحيوانات الأخرى، وكان فرانسيز كولينز في طليعة هؤلاء الذين يعملون على إشاعة تلك الحجج بين العامة وخصوصا ضمن المجتمع المؤمن، ووفقا لكولينز فلا مجال للإنكار: "لقد أدت دراسات الجينوم إلى الاستنتاج بموثوقية أن البشر يشتركون مع بقية الكائنات الحية بسلف واحد،(49) من المؤكد أننا نشترك بسلف واحد مع القردة، كما أن من المؤكد أننا نشترك مع الفئران بسلف واحد".(50)
وبغض النظر عن استعمال كولينز لمصطلحات توكيدية، إلا أن الدليل الذي قدمه والقائم على أساس جيني لا يدعم ما يدعيه.
يؤكد الدليل الذي ناقشناه في هذا الفصل الشيء الذي نعرفه سابقا بأن الإنسان والشمبانزي يتشاركان بتسلسلات جينية وظيفية متشابهة، يمكن تفسير هذا التشابه بوجود تصميم مشترك بنفس الدرجة التي يمكن تفسيرها بافتراض وجود سلف مشترك... ماذا تبقى؟
لا شيء.
رأينا أن حجج الدنا الخردة التي قدمها كولينز تتلاشى مع مرور الزمن، فمع كل شهر يمضي تكشف دراسات جديدة عن وظائف كثيرة للحمض النووي غير المشفر(51)، وقد اكتشف علماء الأحياء على وجه الخصوص أدلة واسعة النطاق لوجود وظائف للعناصر غير المشفرة كما حدث مع عناصر الدنا المتكررة القديمة AREs، وكما حدث مع الجين الكاذب -وهي الأنواع من الدنا التي ادعى كولينز وغيره أنها بلا وظائف وأنها حطام جيني ومهملات بلا قيمة-، واستدلوا بها على وجود السلف المشترك بين الإنسان والقردة.
وكذلك الأمر فقد سقطت حجة الاندماج الصبغي التي قدمها كولينز، وحتى لو أن الاندماج الصبغي قد حدث، فإن ذلك لن يخبرنا بشيء عما إذا كنا نشترك مع القردة بسلف واحد، وليس من الواضح تماما فيما إذا كان الاندماج الصبغي قد حدث بالفعل، كما أن الدنا التيلوميري البيني ITS لا يشير بالضرورة إلى حدوث اندماج صبغي، وكذلك فإن هذه التسلسلات في (الصبغي البشري 2) متباعدة بدرجة كبيرة عن تلك التي نتوقع وجودها لو كان هناك اندماج صبغي حديث.
وكداعم لفكرة أن التصميم الذكي قادر على تفسير العديد من جوانب الطبيعية -بطريقة أفضل من تفسيرها بأنها عمليات عشوائية غير موجهة-؛ فإني أريد أن أشير إلى أن التصميم الذكي لا يتعارض في المبدأ مع اشتراك الإنسان مع باقي الكائنات بسلف مشترك، فالتصميم الذكي -في جوهره- لا يقف ضد السلف المشترك، ولكنه يتعارض مع الادعاء القائل بأن التعقيد الموجود في الحياة قد نشأ بعمليات عشوائية غير موجهة كالطفرات العشوائية والانتخاب الطبيعي، وبالتالي فإن نموذج السلف المشترك الموجه يتلاءم مع فكرة التصميم الذكي.
ومع ذلك، فإن المنظِّرين للتصميم الذكي -بخلاف أنصار التطور الدارويني- ليسوا مُلزَمين بقبول السلف المشترك بين الإنسان والقردة، وهم أحرار ليتبعوا الدليل حيثما يقودهم، ولن يقودهم الدليل إلى استنتاجات فرانسيز كولينز، لقد رأينا أن الحجج الجينية المستخدمة للدلالة على وجود السلف المشترك بين الإنسان والقردة مستندة بشكل كبير على الافتراضات الداروينية وعلى معطيات قد عفا عليها الزمن أكثر من استنادها على الاستدلالات الدقيقة.
(1) Francis Collins, The Language of God: A Scientist Presents Evidence for Belief (New York: Free Press, 2006), 127-28.
(2) See: David Klinghoffer, “Francis Collins: A Biography.” Wesley J. Smith, “Collins Heads NIH,” To the Point (July 30, 2009). David Klinghoffer, “Francis Collins on Abortion,” BeliefNet (July 8, 2009).
(3) For information about the Templeton grant to launch BioLogos, see “The Language of God: BioLogos Website and Workshop,” John Templeton Foundation, accessed March 19, 2012, http://www.templeton.org/what-wefund/grants/the-language-of-god-biologos-website-and-workshop.
(4) Collins, Language of God, 136-37.
(5) Ibid., 138.
(6) Ibid., 134.
(7) Ibid., 136-37.
(8) Ibid.
(9) Richard Dawkins, “The Information Challenge,” The Skeptic, 18 (December,1998).
(10) Richard Sternberg, “On the Roles of Repetitive DNA Elements in the Context of a Unified Genomic-Epigenetic System,” Annals of the New York Academy of Sciences, 981 (2002): 154-88.
(11) Ibid.
(12) Sternberg, “On the Roles of Repetitive DNA Elements in the Context of a Unified Genomic-Epigenetic System,” 154-88.
(13) Tammy A. Morrish, Nicolas Gilbert, Jeremy S. Myers, Bethaney J. Vincent, Thomas D. Stamato, Guillermo E. Taccioli, Mark A. Batzer, and John V. Moran, “DNA repair mediated by endonuclease-independent LINE-1 retrotransposition,” Nature Genetics, 31 (June, 2002): 159-65.
(14) Galit Lev-Maor, Rotem Sorek, Noam Shomron, and Gil Ast, “The birth of an alternatively spliced exon: 3’ splice-site selection in Alu exons,” Science, 300 (May 23, 2003): 1288-91; Wojciech Makalowski, “Not junk after all,” Science, 300 (May 23, 2003): 1246-47.
(15) Nurit Paz-Yaacova, Erez Y. Levanonc, Eviatar Nevod, Yaron Kinare, Alon Harmelinf, Jasmine Jacob-Hirscha, Ninette Amariglioa, Eli Eisenbergg, and Gideon Rechavi, “Adenosine-to-inosine RNA editing shapes transcriptome diversity in primates,” Proceedings of the National Academy of Sciences USA, 107 (July 6, 2010): 12174-79.
(16) Morrish et al., “DNA repair mediated by endonuclease-independent LINE-1 retrotransposition,” 159-65; Annie Tremblay, Maria Jasin, and Pierre Chartrand, “A Double-Strand Break in a Chromosomal LINE Element Can Be Repaired by Gene Conversion with Various Endogenous LINE Elements in Mouse Cells,” Molecular and Cellular Biology, 20 (January, 2000): 54-60; Ulf Grawunder, Matthias Wilm, Xiantuo Wu, Peter Kulesza, Thomas E. Wilson, Matthias Mann, and Michael R. Lieber, “Activity of DNAligase IV stimulated by complex formation with XRCC4 protein in mammalian cells,” Nature, 388 (July 31, 1997): 492-95; Thomas E. Wilson, Ulf Grawunder, and Michael R. Lieber, “Yeast DNA ligase IV mediates non-homologous DNA end joining,” Nature, 388 (July 31, 1997): 495-98.
(17) Richard Sternberg and James A. Shapiro, “How repeated retroelements format genome function,” Cytogenetic and Genome Research, 110 (2005): 108-16.
(18) Jeffrey S. Han, Suzanne T. Szak, and Jef D. Boeke, “Transcriptional disruption by the L1 retrotransposon and implications for mammalian transcriptomes,” Nature, 429 (May 20, 2004): 268-74; Bethany A. Janowski, Kenneth E. Huffman, Jacob C. Schwartz, Rosalyn Ram, Daniel Hardy, David S. Shames, John D. Minna, and David R. Corey, “Inhibiting gene expression at transcription start sites in chromosomal DNA with antigene RNAs,” Nature Chemical Biology, 1 (September, 2005): 216-22; J. A. Goodrich, and J. F. Kugel, “Non-coding-RNA regulators of RNA polymerase II transcription,” Nature Reviews Molecular and Cell Biology, 7 (August, 2006): 612-16; L.C. Li, S. T. Okino, H. Zhao, H., D. Pookot, R. F. Place, S. Urakami, H.. Enokida, and R. Dahiya, “Small dsRNAs induce transcriptional activation in human cells,” Proceedings of the National Academy of Sciences USA, 103 (November 14, 2006): 17337-42; A. Pagano, M. Castelnuovo, F. Tortelli, R. Ferrari, G. Dieci, and R. Cancedda, “New small nuclear RNA gene-like transcriptional units as sources of regulatory transcripts,” PLoS Genetics, 3(February, 2007): e1; L. N. van de Lagemaat, J. R. Landry, D. L. Mager, and P. Medstrand, “Transposable elements in mammals promote regulatory variation and diversification of genes with specialized functions,” Trends in Genetics, 19 (October, 2003): 530-36; S. R. Donnelly, T. E. Hawkins, and S. E. Moss, “A Conserved nuclear element with a role in mammalian gene regulation,” Human Molecular Genetics, 8 (1999): 1723-28; C. A. Dunn, P. Medstrand, and D. L. Mager, “An endogenous retroviral long terminal repeat is the dominant promoter for human B1,3-galactosyltransferase 5 in the colon,” Proceedings of the National Academy of Sciences USA, 100 (October 28, 2003):12841-46; B. Burgess-Beusse, C. Farrell, M. Gaszner, M. Litt, V. Mutskov, F. Recillas-Targa, M. Simpson, A. West, and G. Felsenfeld, “The insulation of genes from external enhancers and silencing chromatin,” Proceedings of the National Academy of Sciences USA, 99 (December 10, 2002): 16433-37; P. Medstrand, Josette-Renée Landry, and D. L. Mager, “Long Terminal Repeats Are Used as Alternative Promoters for the Endothelin B Receptor and Apolipoprotein C-I Genes in Humans,” Journal of Biological Chemistry, 276 (January 19, 2001): 1896-1903; L. Mariٌo-Ramيreza, K.C. Lewisb, D. Landsmana, and I.K. Jordan, “Transposable elements donate lineage- specific regulatory sequences to host genomes,” Cytogenetic and Genome Research, 110 (2005):333-41.
(19) S. Henikoff, K. Ahmad, and H. S. Malik “The Centromere Paradox: Stable Inheritance with Rapidly Evolving DNA,” Science, 293 (August 10, 2001): 1098-1102; C. Bell, A. G. West, and G. Felsenfeld, “Insulators and Boundaries: Versatile Regulatory Elements in the Eukaryotic Genome,” Science, 291 (January 19, 2001): 447-50; M.-L. Pardue & P. G. DeBaryshe, “Drosophila telomeres: two transposable elements with important roles in chromosomes,” Genetica, 107 (1999): 189-96; S. Henikoff, “Heterochromatin function in complex genomes,” Biochimica et Biophysica Acta, 1470 (February, 2000): O1-O8; L. M.Figueiredo, L. H. Freitas-Junior, E. Bottius, Jean-Christophe Olivo-Marin, and A. Scherf, “A central role for Plasmodium falciparum subtelomeric regions in spatial positioning and telomere length regulation,” The EMBO Journal, 21 (2002): 815-24; Mary G. Schueler, Anne W. Higgins, M. Katharine Rudd, Karen Gustashaw, and Huntington F. Willard, “Genomic and Genetic Definition of a Functional Human Centromere,” Science, 294 (October 5, 2001): 109-15.
(20) Ling-Ling Chen, Joshua N. DeCerbo and Gordon G. Carmichael, “Alu element- mediated gene silencing,” The EMBO Journal 27 (2008): 1694-1705; Jerzy Jurka, “Evolutionary impact of human Alu repetitive elements,” Current Opinion in Genetics & Development, 14 (2004): 603-8; G. Lev-Maor et al. “The birth of an alternatively spliced exon: 3’ splice-site selection in Alu exons,” 1288-91; E. Kondo-Iida, K. Kobayashi, M. Watanabe, J. Sasaki, T. Kumagai, H. Koide, K. Saito, M. Osawa, Y. Nakamura, and T. Toda, “Novel mutations and genotype-phenotype relationships in 107 families with Fukuyamatype congenital muscular dystrophy (FCMD),” Human Molecular Genetics, 8 (1999): 2303-09; John S. Mattick and Igor V. Makunin, “Non-coding RNA,” Human Molecular Genetics, 15 (2006): R17-R29.
(21) M. Mura, P. Murcia, M. Caporale, T. E. Spencer, K. Nagashima, A. Rein, and M. Palmarini, “Late viral interference induced by transdominant Gag of an endogenous retrovirus,” Proceedings of the National Academy of Sciences USA, 101 (July 27, 2004): 11117-22; M. Kandouz, A. Bier, G. D Carystinos, M. A Alaoui-Jamali, and G. Batist, “Connexin43 pseudogene is expressed in tumor cells and inhibits growth,” Oncogene, 23 (2004): 4763-70.
(22) K. A. Dunlap, M. Palmarini, M. Varela, R. C. Burghardt, K. Hayashi, J. L. Farmer, and T. E. Spencer, “Endogenous retroviruses regulate periimplantation placental growth and differentiation,” Proceedings of the National Academy of Sciences USA, 103 (September 26, 2006): 14390-95; L. Hyslop, M. Stojkovic, L. Armstrong, T. Walter, P. Stojkovic, S. Przyborski, M. Herbert, A. Murdoch, T. Strachan, and M. Lakoa, “Downregulation of NANOG Induces Differentiation of Human Embryonic Stem Cells to Extraembryonic Lineages,” Stem Cells, 23 (2005): 1035-43; E. Peaston, A. V. Evsikov, J. H. Graber, W. N. de Vries, A. E. Holbrook, D. Solter, and B. B. Knowles, “Retrotransposons Regulate Host Genes in Mouse Oocytes and Preimplantation Embryos,” Developmental Cell, 7 (October, 2004): 597-606.
(23) Sternberg Shapiro, “How Repeated Retroelements format genome function,”108-16.
(24) Rick Weiss, “Intricate Toiling Found In Nooks of DNA Once Believed to Stand Idle,” Washington Post (June 14, 2007), accessed March 6, 2012, http://www.washingtonpost.com/wp-dyn/content/article/2007/06/13/AR2007061302466_pf.html.
(25) Erika Check Hayden, “Human Genome at Ten: Life is Complicated,” Nature,464 (April 1, 2010): 664-67.
(26) Philipp Kapranov, Aarron T. Willingham, and Thomas R. Gingeras, “Genome- wide transcription and the implications for genomic organization,” Nature Reviews Genetics, 8 (June, 2007): 413-23.
(27) Paulo P. Amaral, Marcel E. Dinger, Tim R. Mercer, and John S. Mattick, “The Eukaryotic Genome as an RNA Machine,” Science, 319 (March 28, 2008): 1787-89. 28.
(28) Ibid.
(29) Makalowski, “Not Junk After All,” 1246-47.
(30) Ibid.
(31) Collins, The Language of God, pg. 139.
(32) Karl Giberson and Francis Collins, The Language of Science and Faith: Straight Answers to Genuine Questions (Downers Grove, IL: InterVarsity Press, 2011),43.
(33) Private correspondence with Dr. Miller.
(34) See for example D. Zheng and M. B. Gerstein, “The ambiguous boundary between genes and pseudogenes: the dead rise up, or do they?,” Trends in Genetics, 23 (May, 2007): 219-24; S. Hirotsune et al., “An expressed pseudogene regulates the messenger-RNA stability of its homologous coding gene,” Nature, 423 (May 1, 2003): 91-96; O. H. Tam et al., “Pseudogene-derived small interfering RNAs regulate gene expression in mouse oocytes,” Nature, 453 (May 22, 2008): 534-38; D. Pain et al., “Multiple Retropseudogenes from Pluripotent Cell-specific Gene Expression Indicates a Potential Signature for Novel Gene Identification,” The Journal of Biological Chemistry, 280 (February 25, 2005):6265-68; J. Zhang et al., “NANOGP8 is a retrogene expressed in cancers,” FEBS Journal, 273 (2006): 1723-30.
(35) Evgeniy S. Balakirev and Francisco J. Ayala, “Pseudogenes, Are They ‘Junk’or Functional DNA?,” Annual Review of Genetics, 37 (2003): 123-51.
(36) Ryan Charles Pink, Kate Wicks, Daniel Paul Caley, Emma Kathleen Punch, Laura Jacobs, and David Paul Francisco Carter, “Pseudogenes: Pseudo-functional or key regulators in health and disease?,” RNA, 17 (2011): 792-98.
(37) يقر كولينز بأن جينة الـcaspase-12 تنتج بروتينا وظيفيّا مهما في الشمبانزي، لذا فليست القضية هنا أن البشر يشتركون بنفس التسلسل الجيني غير المشفر الذي لدى غيرهم من الكائنات، هذه الجينة ليست كاذبة عند كل البشر، وفقا لورقة علمية نشرت في مجلة The American Journal of Human Genetics فإن 28% من البشر الموجودين في مناطق تحت الصحراء الكبرى الإفريقية يمتلكون نسخة وظيفية من هذه الجينة، وتوجد بنسب أقل في جماعات بشرية أخرى، يتجاهل كولنز إمكانية حصول سيناريو أن الجينة caspase-12 قد صممت لإنتاج بروتين معين ثم تعرضت لطفرة عند البشر جعلت منها غير وظيفية في زمن ما.
See: Yali Xue, Allan Daly, Bryndis Yngvadottir, Mengning Liu, Graham Coop, Yuseob Kim, Pardis Sabeti, Yuan Chen, Jim Stalker, Elizabeth Huckle, John Burton, Steven Leonard, Jane Rogers, and Chris Tyler-Smith, “Spread of an Inactive Form of Caspase-12 in Humans Is Due to Recent Positive Selection,” The American Journal of Human Genetics, 78 (April, 2006): 659-70.
(38) M. Lamkanfi, M. Kalai, and P. Vandenabeele, “Caspase-12: an overview,” Cell Death and Differentiation, 11: (2004)365-68.
(39) Sug Hyung Lee, Christian Stehlik, and John C. Reed, “COP, a Caspase Recruitment Domain-containing Protein and Inhibitor of Caspase-1 Activation Processing,” The Journal of Biological Chemistry, 276 (September 14, 2001): 34495-500.
(40) Lamkanfi, Kalai, and Vandenabeele, “Caspase-12: an overview,” 365-68.
(41) Collins, quoted in Catherine Shaffer, “One Scientist’s Junk Is a Creationist’s Treasure,” Wired Magazine Blog (June 13, 2007), accessed March 6, 2012, .
(42) See discussion in Jonathan Wells, The Myth of Junk DNA (Seattle: Discovery Institute Press, 2011), 98-100.
(43) Collins, The Language of God, 138.
(44) Jonathan Marks, What it means to be 98% Chimpanzee: Apes, People, and their Genes (Los Angeles: University of California Press, 2003), 39.
(45) Kenneth R. Miller, Only a Theory: Evolution and the Battle for America’s Soul (New York: Viking, 2008), 107.
(46) Daniel Fairbanks, Relics of Eden: The Powerful Evidence of Evolution in Human DNA (Amherst, NY: Prometheus, 2007), 27.
(47) Yuxin Fan, Elena Linardopoulou, Cynthia Friedman, Eleanor Williams, and Barbara J. Trask, “Genomic Structure and Evolution of the Ancestral Chromosome Fusion Site in 2q13-2q14.1 and Paralogous Regions on Other Human Chromosomes,” Genome Research, 12 (2002): 1651-62.
(48) Richard Sternberg, “Guy Walks Into a Bar and Thinks He’s a Chimpanzee: The Unbearable Lightness of Chimp-Human Genome Similarity,” Evolution News & Views (May 14, 2009), accessed March 6, 2012. http://www.evolutionnews.org/2009/05/guy_walks_into_a_bar_and_think020401.html (internal citations removed).
(49) Collins, The Language of God, 133-34.50. Ibid., 136-37.51. For an in-depth discussion of these studies, see Wells, The Myth of Junk DNA.
(50) Ibid., 136-37.